版权归原作者所有,如有侵权,请联系我们
氡与氦:同出异途的稀有气体(上)
上传时间:2026-02-12 10:04 来源:自然资源科普与文化
作者:李玉宏 李济远 周俊林
简介:
当温泉池的氤氲雾气中回响养生传说,当盛大庆典上的气球带着欢乐喜庆飘向天空,很少有人会意识到,这两种看似毫无关联的场景中,藏着一对来自元素周期表的“特殊伙伴”——氡与氦。
当温泉池的氤氲雾气中回响养生传说,当盛大庆典上的气球带着欢乐喜庆飘向天空,很少有人会意识到,这两种看似毫无关联的场景中,藏着一对来自元素周期表的“特殊伙伴”——氡与氦。能让声音变尖的氦气是航天发射不可或缺的“稀有精灵”,在低温领域不可替代的作用使其成为“拯救生命”的“贵族气体”;而藏在建筑地基与岩石缝隙中的氡气却是关乎室内环境安全的“隐形杀手”。它们同属稀有气体家族,共享着化学性质稳定的“家族基因”,却在密度、毒性与应用场景中走向了截然不同的端元。二者“同出异途”的奇妙羁绊,恰是揭开稀有气体神秘面纱的绝佳入口。

蓝绿星球 视觉中国 / 供
一、幽微之辨:氡与氦的基本性质
氡气(radon,Rn)是一种有害气体,氦气(helium,He)是重要的稀有战略资源,然二者在地球上的生成和迁移关系密切。这两种气体的形成与迁移不仅涉及复杂的地质过程,还在资源勘探中具有重要应用价值。此外,氡及其子体的团簇现象也是一个值得深入研究的重要现象。
氡原子序数为86,其单质形态通常为气态,是无色、无臭、无味的惰性气体(也称稀有气体),具有放射性。氡的化学性质不活泼,难以与其他元素发生反应形成化合物。
氦原子序数为2,是宇宙中较早形成的元素之一,也是仅次于氢的第二轻气体,密度仅为空气的1/7,这一特性使其能轻松带动气球升空。氦气最显著的特点是化学性质极其稳定,几乎不与任何物质发生化学反应,同时具备极低的沸点(-268.9℃),是已知最难液化的气体。
19世纪末,科学家们发现了钍会持续释放一种气态放射性物质,该物质具有化学惰性且原子量较高,因来源于钍而称其为钍射气,符号为 ThEm。1900年,德国物理学家多恩同样发现了镭射气(radium emantion),符号为 RaEm。1903年,又有研究者发现一种锕射气(actinium emantion,AcEm),以及一种名为niton的惰性气体。随后,在1918年,德国化学家施密特对这些发现进行了系统梳理。他参照惰性气体氩、氖等的命名方式,将钍射气更名为thoron,元素符号定为Tn,正式确定其为一种元素;又将镭射气更名为radon,元素符号定为Rn。后来经进一步研究证实,钍射气本质是氡-220,锕射气是氡-219,niton 是氡-222,三者均为氡的天然同位素。

科技浮翼 视觉中国 / 供
“兴登堡号”飞艇事故
飞艇曾承载着人类的飞行梦想。德国“兴登堡号”飞艇被誉为“空中泰坦尼克号”,一度是上流社会的象征。1936年,它完成了首次横越大西洋的飞行。这艘长度超过240米的飞艇,是当时世界上建造的最大飞艇。乘客可坐在舒适豪华、设备齐全的机舱内,以每小时135千米的速度飞行。它曾10次安全往返于大西洋两岸,累计载客1002人次。
1937年5月6日下午约7时30分,“兴登堡号”飞艇在美国新泽西州莱克赫斯特海军航空总站上空准备着陆时,一个火花点燃了泄露的氢气,仅用34秒,整艘飞艇便被熊熊烈火吞噬。
事实上,氦气曾是“兴登堡号”飞艇浮力气体的首选——它是当时可用于飞艇的最安全气体。但在建造“兴登堡号”的年代,氦气极为稀有且价格昂贵,当时仅有美国具备氦气生产的能力,而美国因担忧德国可能将氦气用于武器制造,对其实施了出口管制。
尽管氢气易燃易爆,可除了氢气,当时尚无其他可大规模生产的气体能为飞艇提供足够升力。同时,氢气可被任何工业国家以低廉成本大量生产,且比氦气更轻,能提供更强的浮力。因此,“兴登堡号”最终仍选择了氢气作为浮力气体。
然而,外泄的氢气最终引发了这场惨烈火灾。地面上的人们束手无策,只能眼睁睁看着容积将近20万立方米的氢气囊几乎瞬间被烈焰吞没,燃烧的飞艇骨架坠地后摔得粉碎,“兴登堡号”在浓烟中彻底焚毁。经过海军人员与乘务人员的全力营救,97名乘客及乘务人员中虽有多人获救,但仍有约36人不幸遇难。

“兴登堡号”着陆时起火爆炸 视觉中国 / 供
二、溯源寻踪:氡与氦的生成和迁移机制
氡与氦的生成与关联性
氡是地壳中放射性铀、镭和钍的蜕变产物,是一种放射性稀有气体,地壳中含有放射性元素的岩石总是不断向四周扩散氡气,使得空气和地下水中始终含有一定量的氡气。在氡的 3 种天然同位素中,只有氡-222的半衰期略长(3.825天),这使其有足够的时间从土壤和岩石中释放出来,穿过地面向上传播并扩散到空气中。氡-219和氡-220的半衰期均以秒计,在空气中含量甚微。此外,氡-222也可能存在于地下水中,会在人们使用地下水时,释放到空气中。
氦也是一种稀有气体,主要通过两种途径生成:放射性衰变和宇宙射线作用。氦-4是由铀-238、铀-235、钍-232等重元素通过α衰变产生,每个α粒子实际上是一个氦-4原子核。因此,在铀、钍的衰变链中,氦会持续生成。氦-3则主要是宇宙射线与大气中的氮、氧原子核相互作用的产物。
氡和氦的生成关系紧密,在富铀地区,氡的生成过程会伴随大量氦的产生。地表和大气中主要存在的是氡-222,氡-222主要来源于放射性同位素镭-226的衰变,而镭-226是铀-238衰变链中的一员,在这个衰变链中,铀-238衰变形成1个氡-222时,会伴随4个α粒子的释放,而1个氡-222的衰变最终又可释放4个α粒子。由于铀钍元素密切伴生,铀-238衰变形成氡-222的过程中,必然伴随有铀-235、钍-232等衰变,同时生成更多的α粒子。
正因为氡和氦的生成关系密切,富含氡的地区往往也是氦资源富集区。通过勘探氡的浓度,可以间接推测该地区氦的储存量,这对氦气资源的勘探具有重要指导意义。例如,在寻找氦气资源时,可先检测地下氡气浓度,氡气浓度高的区域,往往预示着氦气的潜在富集。
氡与氦的迁移机制
氡气的迁移主要依靠扩散和对流机制,在地下环境中,氡气先从岩石或土壤的微小裂缝和孔隙中释放出来,随后通过扩散作用,或被地下水携带,逐步向上移动。扩散是指氡气分子从高浓度区域向低浓度区域迁移,这种机制在多孔介质中起主要作用;对流则是地下水流动、温度变化等因素导致氡气随流体一起运动。裂隙、断层等地质构造也为氡气提供了快速向上迁移的通道。岩石和土壤的孔隙度决定了氡气的运移路径和速度,孔隙度高的介质(如沙土)有利于氡气的快速迁移,而孔隙度低的介质(如黏土)则会限制氡气的移动;断层活动可以使深部的氡气沿着这些构造带快速上升,甚至到达地表。这些构造为氡气从深层到表层的快速上升提供了通道。地下的温度和压力变化也会影响氡气的运移,温度升高通常会加速氡气的扩散速度,而压力的变化则会影响氡气的释放和迁移路径,例如,地震活动可以导致地下压力的急剧变化,从而加速氡气的释放和迁移。
氦气由于其惰性和低溶解度,能够在地壳中积累并通过扩散和对流的方式迁移。氦气比氡气更轻,因此更容易通过扩散机制向上迁移。它在岩石和土壤中的迁移路径与氡相似,但由于氦的惰性,不容易与其他元素或矿物发生反应,因此迁移路径相对简单。此外,氦气可以溶解于地下水中并随水流动,但其溶解度比氡气低。
氡与氦的迁移关系
氡和氦均是气态,虽然氡与氦的成因和化学性质不同,但它们在地壳中的迁移路径却有一定相似之处。二者都可以通过扩散和对流机制迁移,也都能够沿着裂隙和断层等通道快速向上迁移。然而,氡与氦在迁移过程中存在显著差异。由于氡在水中溶解度高,而氦的溶解度低,所以地下水流动对它们的迁移影响有所不同。另外,由于氡具有放射性,会在迁移过程中不断衰变,其子体也具有放射性并可能吸附在土壤和岩石颗粒上,影响其迁移行为;氦则不具有放射性,其惰性特质使其迁移路径更加简单和直接,不会受到物理作用的影响。
总结来说,氡和氦的生成过程有着密切关系,在地下的迁移路径也有相似之处,但由于放射性和溶解度的差异,它们的迁移行为存在显著不同。了解这些差异有助于预测和解释地质过程中氡与氦的行为和分布,为资源勘探提供重要线索。
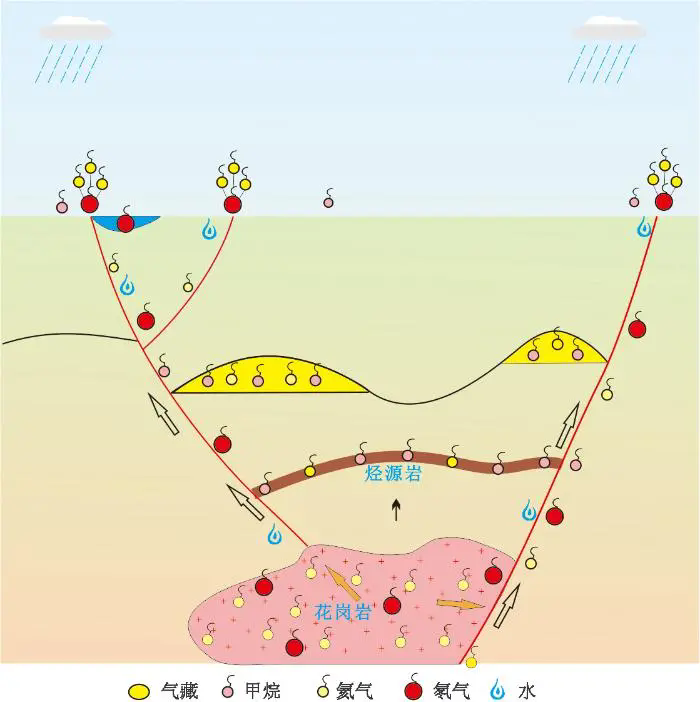
氡与氦的迁移
编辑:李苒苒
校对:张 凡
审核:陈 萍
免责声明:本文为转载,文中观点仅供地学爱好者参考,不代表本网站观点和立场。




